프롤로그: 구조 생물학의 패러다임 변화
2024년 5월, 구글 딥마인드(Google DeepMind)의 AlphaFold 3(이하 AF3) 발표는 구조 생물학계에 다시 한번 큰 화두를 던졌습니다. 단백질-단백질 상호작용을 넘어 DNA, RNA, 리간드 및 이온과의 결합 구조까지 예측 범위가 확장되면서, 일각에서는 실험을 통한 구조 결정의 시대가 끝났다는 전망을 내놓기도 합니다. 그러나 실제 연구 현장에서 Cryo-EM(초저온 전자현미경)을 통해 복합체 구조를 분석하는 실무자의 관점에서, AF3는 실험을 대체하는 수단이 아닌 실험의 효율성을 극대화하는 강력한 보완재에 가깝습니다.
1. AlphaFold 3의 기술적 진보: Diffusion 모델의 도입
AF3의 가장 큰 변화는 기존 AlphaFold 2의 Transformer 기반 아키텍처에서 Diffusion 모델로의 전환입니다. 이를 통해 다음과 같은 기술적 진보를 이뤄냈습니다.
- 다양한 생체 분자 수용: 단백질뿐만 아니라 핵산(DNA/RNA), 저분자 화합물(Ligand), 무기 이온 및 글리칸(Glycan)까지 포함된 복합체 구조 예측이 가능해졌습니다.
- 리간드 결합 정확도 향상: 기존의 도킹(Docking) 시뮬레이션 대비 단백질-리간드 결합 예측의 RMSD 수치를 유의미하게 낮추었습니다.
- 공유 결합 수정(PTM) 반영: 인산화나 당화와 같은 번역 후 수정 상태를 포함한 구조 예측을 지원합니다.
2. Cryo-EM의 독자적 가치: 구조적 불균일성(Structural Heterogeneity)
AF3의 비약적인 발전에도 불구하고, 실험 데이터인 Cryo-EM 맵이 ‘최종적인 진실(Ground Truth)‘로서 기능하는 이유는 단백질의 동역학적 특성 때문입니다.
- Ensemble 분석: AF3는 에너지적으로 가장 안정한 정적 상태(Static state)를 단일 모델로 제시하는 경향이 있습니다. 반면 Cryo-EM은 3D Classification 기법을 통해 단백질이 용액 내에서 가지는 다양한 배좌(Conformation)를 동시에 포착할 수 있습니다.
- 생화학적 환경의 실재성: 특정 pH, 이온 강도, 혹은 나노디스크(Nanodisc)와 같은 지질 환경이 구조에 미치는 영향은 모델링이 아닌 실험 데이터의 Density 분포를 통해서만 정량화할 수 있습니다.
3. 실무 사례: Mdn1+6 ATP의 예측과 실측 비교
거대 복합체 분석에서 예측 모델과 실험 데이터가 어떻게 공생하는지 보여주는 좋은 예시는 AAA+ ATPase인 Mdn1입니다.
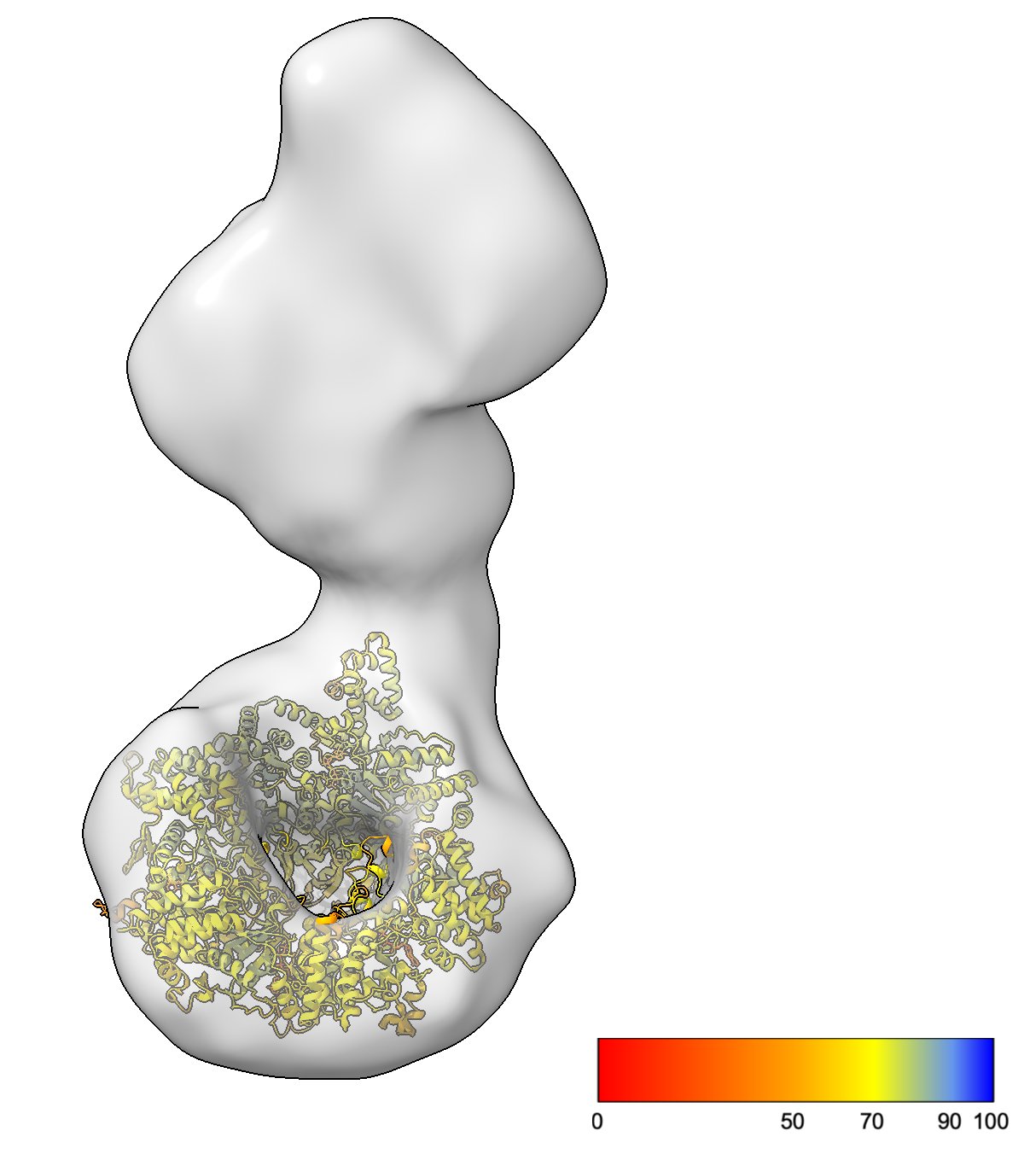
[Figure 1] Mdn1+6 ATP의 AlphaFold 3 예측 모델과 Negative Stain EM 맵의 비교.
- AF3 Model: AAA+ ATPase 도메인의 고해상도 예측 구조 및 ATP 결합 부위의 정밀한 모델링을 제공합니다.
- Negative Stain Map: 실제 실험을 통해 얻은 Mdn1의 전체적인 포괄(Envelope)을 보여줍니다.
- Insight: AF3 모델을 통해 저해상도 EM 맵에서 해석하기 어려운 세부 도메인의 위치를 확정할 수 있으며, 반대로 EM 맵은 AF3 모델이 실제 용액 상태의 거대 복합체 형태를 얼마나 정확히 반영하는지 검증하는 기준이 됩니다.
4. 실무적 통합 워크플로우: Initial Model로서의 활용
현대적인 Cryo-EM 워크플로우에서 AF3는 분석 속도를 가속화하는 핵심 도구로 자리 잡았습니다.
- 초기 모델 수립: 실험 맵을 얻기 전 혹은 저해상도 맵 단계에서 AF3를 통해 고품질의 초기 모델(Initial Model)을 생성합니다.
- 데이터 해석의 가속화: 7Å 이상의 중저해상도 맵에서 각 도메인을 배치(Docking)할 때, AF3의 복합체 예측 모델은 수동 모델링 시간을 획기적으로 단축해 줍니다.
- Refinement의 기준점: Phenix나 Coot을 이용한 Real-space refinement 과정에서 AF3 모델을 참조 구조(Reference)로 활용하여 오차를 줄일 수 있습니다.
결론: 예측과 검증의 시너지, 그리고 연구자의 역할
AlphaFold 3는 연구자들의 역할을 축소하는 것이 아니라, 오히려 연구 영역을 넓히는 도구가 될 것입니다. AF3로 예측한 단백질의 구조 및 역학은 실험을 구축하는 기반이 됩니다. 시뮬레이션을 통한 프리리머리 데이터(Preliminary data)는 실험 방향을 제시하고, Cryo-EM은 그것을 검증하는 수단이 되는 것입니다.
물론 AlphaFold가 스냅샷으로 보이는 하나의 구조만을 예측하기에 다양한 컨포메이션이 나타날 수 있고, 헤테로지니어스가 보이는 결과의 해석은 연구자의 몫으로 남아있을 것입니다. 이러한 두 기술의 결합은 구조 기반 약물 설계, 유전자 치료 및 근본적인 생명과학적 물음에 대한 연구의 속도를 끌어올리고 그 영역을 넓혀갈 것입니다.